Dermatologische Untersuchungen
Wichtige Schritte für eine erfolgreiche mikroskopische und kulturelle Untersuchung von Hautmaterial sind die Wahl des richtigen Probenmaterials, die Technik der Probenentnahme und die Aufbereitung der Probe.
Von Dr. med. vet. Maria Christian und Dr. med. vet. Regina Wagner
Die Haut als größtes Organ des Körpers ist für diagnostische Untersuchungen leicht zugänglich, dennoch ist die Aufarbeitung von dermatologischen Patienten oft schwierig. Daher ist es ratsam, Hautpatienten immer nach einem festgelegten diagnostischen Plan zu untersuchen. Einer ausführlichen Anamnese – am besten anhand eines Anamnesebogens, der schon im Vorfeld (z. B. Warteraum) ausgefüllt wird – und einer klinisch-dermatologischen Untersuchung folgt die eingehendere Begutachtung der Veränderungen, die im dermatologischen Untersuchungsgang festgestellt wurden. Am Beginn der Labordiagnostik steht die mikros- kopische Untersuchung von Material der Hautoberfläche bzw. von Haaren. So können Bakterien, Pilze, Hefen oder Parasiten sowie Entzündungszellen schnell identifiziert werden. Auch für die kulturelle Untersuchung zum Nachweis von Dermatophyten (Hautpilzen) stehen Testkits zur Anwendung in der tierärztlichen Praxis zur Verfügung.
Die Aussagekraft der möglichen Untersuchungen hängt allerdings stark von der Auswahl des richtigen Probenmaterials, der Art der Probenentnahme und der Aufbereitung des gewonnenen Materials ab (siehe Tab. 1).
Klebestreifenabklatsch
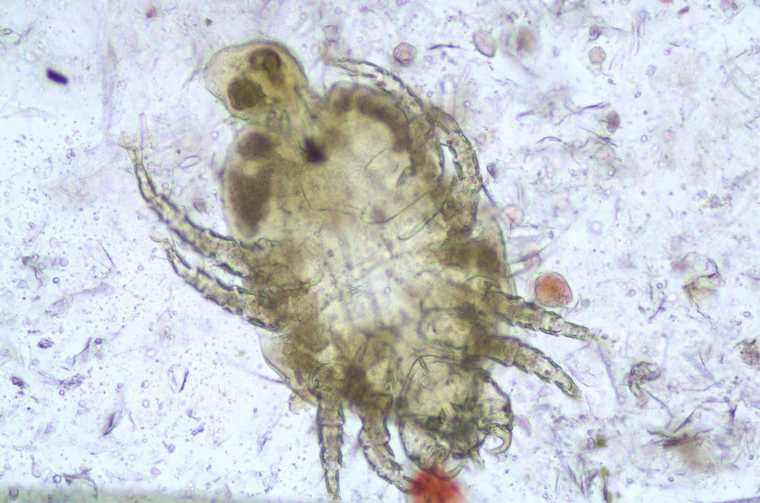
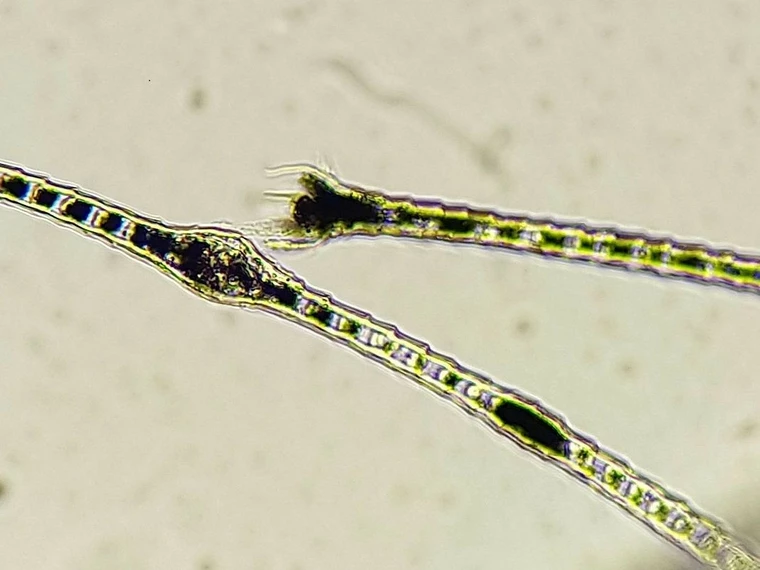
Die beste Methode zum Nachweis von Cheyletiellen (siehe Abb. 1) ist der Klebestreifenabklatsch (siehe auch Schritt-für-Schritt-Anleitung). Diese Milben können Juckreiz und vermehrte Schuppenbildung v. a. am Rücken verursachen. Durch das mehrmalige Andrücken des Klebestreifens auf betroffene Hautstellen wird das Probenmaterial gewonnen. Alternativ können Schuppen zuerst mit einem Kamm gesammelt werden bzw. kann bei massiver Schuppung das Material auch direkt vom Untersuchungstisch aufgenommen werden. Anschließend wird ein Tropfen Paraffinöl auf einen Objektträger aufgebracht und der Klebestreifen darüber geklebt. Das Öl verbessert die Beurteilbarkeit des Materials unter dem Mikroskop. Das Präparat wird mit dem 4x-Objektiv bei weggeklapptem/gesenktem Kondensor komplett durchgemustert, da meistens nur wenige Milben oder deren Eier vorhanden sind.
Top Job:
Oberflächliches Hautgeschabsel
Zum Nachweis von Sarcoptesmilben und den seltener auftretenden Notoedresmilben bei Katzen wird ein oberflächliches Hautgeschabsel angefertigt. Mit einer gebrauchten/stumpfen Skalpellklinge (zur Minimierung der Verletzungsgefahr), die in Paraffinöl getaucht wird (damit das abgeschabte Material haften bleibt), wird an den zuvor geschorenen Hautarealen oberflächlich abgeschabt. Da Sarcoptesmilben meist nur in geringer Zahl vorliegen, wird das Probenmaterial idealerweise an mehreren Stellen (besonders an den Ohrrändern und am Ellbogen) sowie großflächig gewonnen. Außerdem erhöht die Beprobung von frischen Papeln die diagnostische Treffsicherheit.
Die gewonnene Probe wird mit einem weiteren Tropfen Paraffinöl auf einem Objektträger verteilt, mit einem Deckgläschen versehen und im Mikroskop vollständig durchgemustert (4x- oder 10x-Objektiv mit weggeklapptem oder gesenktem Kondensor).
Zur Diagnose einer Sarcoptesräude stehen außerdem eine PCR aus einem Hautgeschabsel (ohne Paraffinöl) bzw. eine Antikörper-Titer-Bestimmung aus dem Serum zur Verfügung.
Tiefes Hautgeschabsel
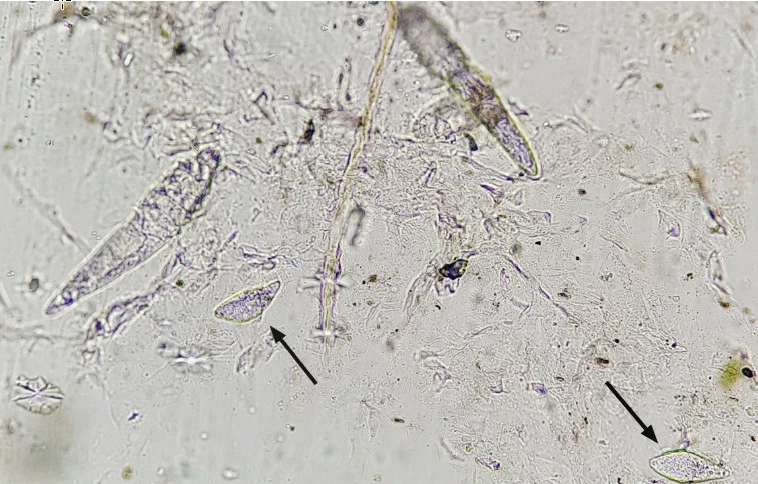
Demodexmilben (siehe Abb. 2) leben tief in den Haarfollikeln, daher dient das tiefe Hautgeschabsel der Diagnose der Demodikose. Mit einer (stumpfen) Skalpellklinge oder auch einem scharfen Löffel und Paraffinöl (siehe oberflächliches Geschabsel) zur Befeuchtung wird so lange in Haarwuchsrichtung über die Haut geschabt, bis eine kapilläre Blutung entsteht. Zwischen den Schabungen sollte die Haut immer wieder gequetscht werden, um die Milben aus der Tiefe der Haarfollikel an die Oberfläche zu befördern. Beprobt werden am besten jene Stellen, die Effloreszenzen wie Rötung, Alopezie, Schuppung oder Komedonen (Mitesser) bzw. Keratinmanschetten zeigen.
Das abgeschabte Material wird sogleich auf einen Objektträger gestrichen und gut mit dem Öl vermengt, weil das Probenmaterial durch die Blutung zu Klumpen gerinnen kann und somit schlechter beurteilbar wird. Mit einem Deckgläschen versehen wird das Material mit dem 4x- oder 10x-Objektiv untersucht. Demodexmilben sind teilweise in großer Anzahl vorhanden und oft auch am Präparat, sofern epilierte Haare dabei sind, noch entlang der Haarwurzeln zu finden.
Neben dem mikroskopischen Nachweis gibt es zur Diagnose der Demodikose auch eine PCR, die alle bei Hund (D. canis, D. injai, D. cornei) und Katze (D. cati, D. gatoi, D. felis) beschriebenen Arten erfasst.
Zytologie
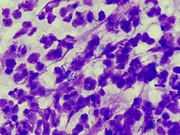
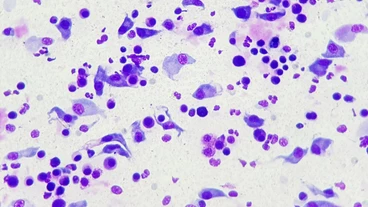
Abklatschpräparate für die zytologische Beurteilung der Hautoberfläche werden besonders im Hinblick auf die Art einer vorliegenden Entzündung oder vorhandene Sekundärinfektionen (siehe Abb. 3) angefertigt. Ein Objektträger wird auf die veränderte Hautstelle angedrückt und anschließend luftgetrocknet. Beim Abklatsch ist darauf zu achten, dass mit dem Objektträger keinesfalls über die Hautveränderungen gewischt wird, da auf diese Weise die Zellen zerstört werden und mikroskopisch nur noch Kernreste und Chromatinfäden zu sehen sind. Sobald das abgeklatschte Material am Objektträger vollständig getrocknet ist, kann das Präparat gefärbt werden. Handelsübliche Schnellfärbungen vom Romanowskytyp sind für die Praxis sehr gut geeignet. Prinzipiell sollten die Färbezeiten des Herstellers beachtet werden, in manchen Fällen ist es jedoch notwendig, die Eintauchzeiten zu verlängern: So brauchen zytologische Präparate, die häufig dicker sind als Blutausstriche, länger bis ausreichend Farbe aufgenommen wird.
Auch wenn die Farbe schon mehrere Wochen verwendet wird, zeigt v. a. die blaue Lösung als erste schlechtere Färbeergebnisse, die an blassen Präparaten zu erkennen sind. Hier kann vorübergehend durch häufigeres oder längeres Eintauchen der Präparate Abhilfe geschaffen und noch ein annehmbares Färbeergebnis erzielt werden. Spätestens wenn auch nach verlängerten Färbezeiten die Zellen im Mikroskop noch immer blass erscheinen oder bei einer Kontamination mit Bakterien, müssen die Farblösungen jedoch ausgetauscht werden. In dicht abschließbaren Gefäßen (z. B. Harnbecher, dicht schließende Gefrierboxen oder Marmeladengläser) sind die Reagenzien über längere Zeit haltbar als in klassischen Färbewannen. Nach dem Abspülen der Farb-reste mit Leitungswasser werden die Präparate erneut luftgetrocknet. In eiligen Fällen kann das auch in einem Brutschrank geschehen oder der Vorgang durch das Platzieren auf einer warmen Oberfläche (z. B. laufende Laborgeräte) oder mit einem Haarföhn beschleunigt werden. Im Mikroskop wird das Präparat zunächst mit geringer Vergrößerung (10x- oder 20x-Objektiv) gescannt, um aussagekräftige Stellen zu finden und diese werden dann mit hoher Vergrößerung (40x bis 100x, Ölimmersion) eingehend beurteilt.
An schwer zugänglichen Lokalisationen (z. B. Zwischenzehenbereich) oder wenn die Haut so trocken ist, dass am Objektträger kein Material haften bleibt, kann mit der Klebestreifen-Methode gearbeitet werden. Der transparente Klebestreifen wird mehrfach auf das betroffene Hautareal gedrückt, bis ausreichend Material haftet und der Streifen nicht mehr klebt (siehe auch Schritt-für-Schritt-Anleitung).
Trichoskopie
Die Trichoskopie ist die Beurteilung von Haaren im Mikroskop. Auf diese Weise können Sporen oder Hyphen von Dermatophyten und manchmal Parasiten (v. a. Demodexmilben) nachgewiesen sowie Veränderungen in der Struktur der Haare selbst erkannt werden. Die Haare werden mit einer Klemme oder Pinzette ausgezupft, mit etwas Öl auf einen Objektträger verbracht und nach dem Abdecken mit einem Deckgläschen im Mikroskop begutachtet.
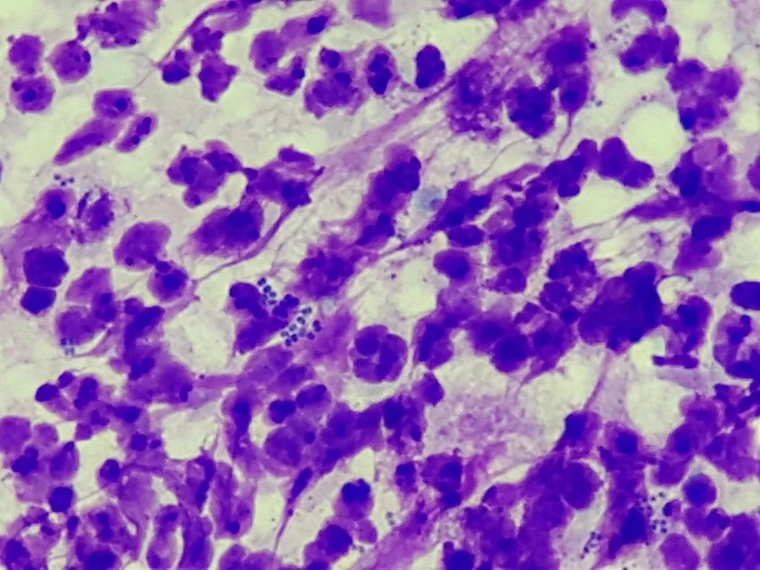
Bei jedem Patient mit Verdacht auf eine Hautpilzerkrankung sollten zeitgleich mit der Probenentnahme für die Kultur oder PCR die Haare auch trichoskopisch untersucht werden (siehe Abb. 4). Werden Pilzhyphen im Haar gefunden oder sind die Haarschäfte von kugeligen Pilzsporen umgeben, kann die Diagnose Dermatophytose (Pilzinfektion der Haut) prompt gestellt und die Therapie unverzüglich eingeleitet werden. Eine kulturelle Untersuchung oder PCR ist jedoch immer durchzuführen: Einerseits weil die Pilzelemente im Mikroskop nicht immer gefunden werden, andererseits kann trichoskopisch die Art des Dermatophyten nicht bestimmt werden.
Auch Demodexmilben können mittels Trichoskopie nachgewiesen werden, wenn die Anfertigung eines tiefen Hautgeschabsels aufgrund der Lokalisation (z. B. um die Augen) oder fehlender Compliance des Patienten nicht möglich ist. Die diagnostische Treffsicherheit eines tiefen Hautgeschabsels ist jedoch deutlich höher. Da Demodexmilben direkt im Haarfollikel an den Haarwurzeln leben, können sie oft mit den Haaren ausgezupft werden. Allerdings sollte man die Haut nicht wie beim Geschabsel quetschen, da auf diese Weise die Milben aus dem Haarfollikel gedrückt werden und nicht mehr an der Wurzel der ausgezupften Haare sitzen.
Ein Trichogramm im engeren Sinne (eingehende trichoskopische Untersuchung der Struktur von Haaren) kann vor allem in der Diagnostik von nicht entzündlichen Alopezien – d. h. bei Fellverlust ohne offensichtliche Veränderungen der Haut – hilfreich sein. Mit einer Klemme oder Pinzette, deren Spitzen mit Gummischläuchen überzogen sind, um eine artifizielle Beschädigung der Haare zu vermeiden, werden Haare von veränderten Lokalisationen ausgezupft. Streng genommen sollten 100 Haare mit Paraffinöl parallel auf einen Objektträger gebettet und mit einem Deckgläschen versehen werden. Die Wurzeln, Haarschäfte und die Haarspitzen werden im Mikroskop mit niedriger Vergrößerung (4x- oder 10x-Objektiv) beurteilt. Viele Haarwurzeln im Telogenstadium (Ruhestadium der Haare vor dem Ausfall) weisen auf das Vorliegen einer endokrinen Erkrankung (Hypothyreose, Hyperadrenokortizismus) hin. Missgebildete Haarwurzeln lenken die Verdachtsdiagnose in Richtung einer Follikeldysplasie.
Bei Patienten mit Farbmutanten-Alopezie (Color Dilution Alopecia – CDA bei Tieren mit verdünnter Fellfarbe wie z. B. Silber oder Blau) und Alopezie der schwarzen Haare sind in den Haarschäften Melaninklumpen (siehe Abb. 5) zu finden, die schlussendlich zum Abbrechen der betroffenen Haare führen. Das Aussehen der Haarspitzen liefert wichtige Hinweise darauf, ob eine Alopezie möglicherweise durch Automutilation, d. h. durch Belecken oder Knabbern am eigenen Fell, entstanden ist. Besonders Katzen zeigen ihren juckreizbedingt gesteigerten Putztrieb häufig nicht vor dem Besitzer. Findet man im Trichogramm abgebrochene Haarspitzen und Spliss, kann man davon ausgehen, dass doch eine juckende Erkrankung vorliegt.
Kulturelle Pilzuntersuchung
Die Haare werden wie für die mikroskopische Untersuchung vom Rand der verdächtigen Läsion ausgezupft und auf das Nährmedium aufgebracht. Bevorzugt werden Haare verwendet, die unter der Wood´schen Lampe grün fluoreszieren. Zur Untersuchung von symptomlosen Tieren bzw. zur Therapiekontrolle nach Abheilung der Hautveränderungen wird das Material für die Pilzkultur am besten mittels McKenzie-Brush-Methode gewonnen. Mit einer neuen Zahnbürste wird das Fell mindestens fünf Minuten lang gebürstet, bei Therapiekontrollen vor allem an jenen Stellen, die ursprünglich betroffen waren. Danach wird die Bürste leicht auf den Nährboden angedrückt und man überträgt zusätzlich einige Haare in die Schale. Beim Ansetzen der Kultur ist es immer wichtig, dass die Haare gleichmäßig und gut haftend auf dem Boden der Schale zum Liegen kommen, ohne das Medium zu zerstören.
Die beimpften Platten werden täglich kontrolliert, um falsch positive Ergebnisse zu vermeiden, die durch die Kultur von Saprophyten/Umgebungspilzen verursacht werden können. Einerseits wird auf das Wachstum von Pilzkolonien geachtet, die im Fall von Dermatophyten weiß sind. Wachsen hingegen Saprophyten, färben sich die Kolonien grau oder grünlich bis schwarz. Außerdem ist es wichtig, einen möglicherweise auftretenden Farbumschlag des Testmediums von Rot auf Gelb zu erkennen. Dermatophyten verursachen schon vor oder spätestens zum Zeitpunkt des Heranwachsens einer Pilzkolonie diesen Farbumschlag, bei Umgebungspilzen erfolgt der Farbwechsel erst Tage nach dem Wachstum der Pilze oder gar nicht. Um die genaue Identität des Pilzes festzustellen, wird mit einem Klebestreifen vorsichtig Material von der Oberfläche der Kolonien entnommen. Auf einen Objektträger wird ein Tropfen Lactophenolblau aufgebracht und der Klebestreifen darüber gelegt. So können im Mikroskop die Makrokonidien der verschiedenen Dermatophyten differenziert werden.
Aufbereitung zytologischer Präparate: Worauf ist zu achten?
- Das Material muss vor dem Färben oder auch vor dem Verpacken für den Versand vollständig getrocknet sein – dauert das sehr lange, ist das Präparat zu dick und möglicherweise schlecht beurteilbar.
- Der Trocknungsvorgang kann durch das Platzieren der Präparate in einem Brutschrank/auf einer warmen Oberfläche oder durch vorsichtiges Föhnen mit lauwarmer Luft beschleunigt werden.
- Bei der Färbung hält man sich prinzipiell an die Angaben des Herstellers – zytologischische Präparate brauchen allerdings zur ausreichenden Farbaufnahme manchmal länger als Blutausstriche. Ist das Material am gefärbten Präparat noch blassrosa, kann die Färbezeit verlängert werden.
- Farblösungen sollten in dicht verschließbaren Gefäßen gelagert werden, da besonders die Fixierlösung sehr schnell verdunstet.
- Färben sich die Präparate trotz verlängerter Eintauchzeiten nicht mehr gut an, müssen die Farblösungen ersetzt werden. Das Gleiche gilt bei einer Kontamination mit Bakterien, die leicht daran zu erkennen ist, dass plötzlich auf allen Präparaten bakterielle Strukturen zu finden sind.
Poster dermatologische Präparate: svg.to/dermapraeparate
Über die Autorinnen
Kontakt zu den Autorinnen:
Dr. med. vet. Maria Christian, christian@laboklin.com, www.laboklin.com
Dr. med. vet. Regina Wagner, regina.wagner@vetderm.at, www.austrian-barbet.com
Sie möchten keine Neuigkeiten mehr verpassen? Dann abonnieren Sie hier den kostenlosen Newsletter von tfa-wissen.de.
Kostenfreier Download
Passend zu diesem Artikel

In unserer neuen Ausgabe unseres TFA-Magazins Tierisch Dabei haben wir jede Menge interessante Fachbeiträge über den anämischen Patienten, Schritt-für-Schritt-Anleitungen, aktuelle Meldungen rund um die Tiermedizin sowie Lese- und Freizeittipps. Bestellen Sie sich jetzt kostenfrei ein Probeheft.

Anatomische Grundlagen, die wichtigsten Erkrankungen der Wirbelsäule und der Einfluss von Ernährung und Bewegung auf die Rehabilitation: Diese und noch mehr spannende Themen gibt es in unserem neuen TFA-Magazin Tierisch Dabei. Bestellen Sie sich jetzt ein kostenfreies Probeheft.

Ein neu entdecktes Wolfsbakterium mit probiotischen Eigenschaften könnte für mehr Darmgesundheit bei Hunden sorgen.